Consecuencias del ataque de patógenos del género Fusarium en los cultivos:
Clasificación, Ciclo de la enfermedad y Distribución. Manejo integrado y Sanidad Vegetal.
Las especies de Fusarium son consideradas uno de los patógenos de plantas más comunes, lo cual tiene grave repercusiones económicas. Según datos de la American Phytopathologcal Society (APS) , aproximadamente el 81% de las plantas económicamente importantes tiene al menos una enfermedad por Fusarium.
Aquí encontrarás la información más relevante de este género, así como los síntomas y señales que provoca el Marchitamiento fúngico o Fusariosis vascular en lechuga. Esta entrada también incluye, consejos para el manejo integrado de la enfermedad y el control biológico de la misma.
1. Taxonomía y Distribución.
Son muchas las especies que encontramos dentro del Género Fusarium. Un punto importante antes de conocer las características de este hongo es saber su taxonomía, es decir, su clasificación científica:
Phylum: Ascomycota
Clase: Sordariomycetes
Orden: Hypocreales
Familia: Nectriaceae
Género: Fusarium
Especie: Fusarium spp.
Fusarium esquiseti
Fusarium oxysporum
Fusarium proliferatum Fusarium reticulatum Fusarium solani Fusarium subglutinans
(Fuente: EPPO, 2020 Fusarium oxysporum (FUSAOX)

Plantación de Plátano afectadas por Fusarium oxysporum

Plantas de Pepino afectada por Fusarium oxysporum
Distribución: Se trata de un género cosmopolita y es endémico de las zonas donde se cultiva maíz (zonas maiceras) en todo el mundo.
La distribución se puede detallar por especie y por plantas hospedadoras, Algunos países dónde se localizan estas especies hospedadoras:
–África, Australia, EE.UU, Europa, Chile, Japón, México, Brasil, Cuba, Indonesia, Alemania, Holanda, también en zonas de cultivo de arroz y regiones templadas del globo.
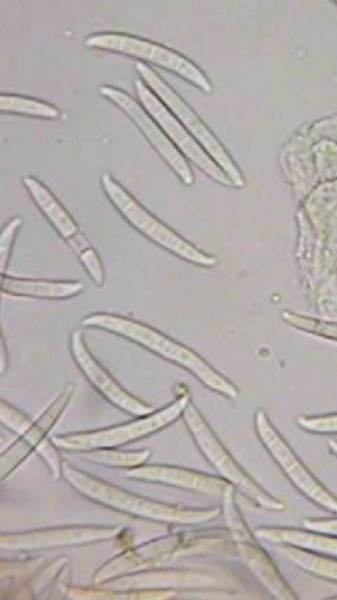
Fusarium oxysporum a través del microscopio
2. Cultivos a los que afecta esta enfermedad.
En el apartado anterior comentamos que la distribución iba ligada a las plantas hospedadoras y que se encuentra en casi todo el globo terráqueo. Las especies de este género afectan un amplio rango de plantas ornamentales y de interés agroeconómico que incluyen monocotiledóneas y dicotiledóneas. Podemos encontrar Fusarium oxyosporum en cultivos de: legumbres, claveles, cereales (maíz, trigo…), plátano, cacao, coníferas, patata, piña, mijo, higo, pastos, mando, bambú, espárragos y arroz, entre otros.
Es tan estrecha la especificidad entre el huésped y el patógeno que ha llevado al concepto de formae especiales (f. sp).
- – oxysporum f.sp. cyclaminis,
- – oxysporum f.sp. dianthi
- – oxysporum f.sp. tulipae
- – oxysporum f.sp. albedinis
- – oxysporum f.sp. melonis
- – oxysporum f.sp. lycopersici
- – oxysporum f.sp. radicis-lycopersici
- – oxysporum f.sp. lactucae
3. Síntomas y señales.
F.oxyosporum es un fitopatógeno que causa dos tipos de síntomas:
- – Marchitez vascular (el patógeno penetra la planta por las raíces, entre en los vasos xilemáticos y se mueve hacia arriba causando clorosis, marchitez y muerte).
- – Pudriciones basales, sin alcanzar el sistema vascular. Estas pudriciones afectan predominantemente a órganos de almacenamiento, como bulbos, cormos, tubérculos y rizomas.
Para diferenciar las cepas que ocasionan pudriciones de las que producen marchitez, se utiliza el término “radicis”, por ejemplo F.oxysporum f.sp. lycopersici (para marchitez) y F.oxysporum f.sp. radicis-lycopersici (para pudrición) .
GLOSARIO
Cormo: Es el cuerpo vegetativo característico de la fase adulta de las cormofitas o plantas vasculares. El cormo lo componen tres tipos de órganos: raíces, tallos y hojas. (Fuente)
Rizoma: Hace referencia al tallo que crece bajo tierra y en horizontal. Es capaz de almacenar nutrientes, funcionando como un órgano de reserva para la planta. (Fuente)
Clorosis: hace referencia a la condición fisiológica que presentan las hojas cuando no producen suficiente clorofila, peresentando una coloración amarillenta (Fuente)
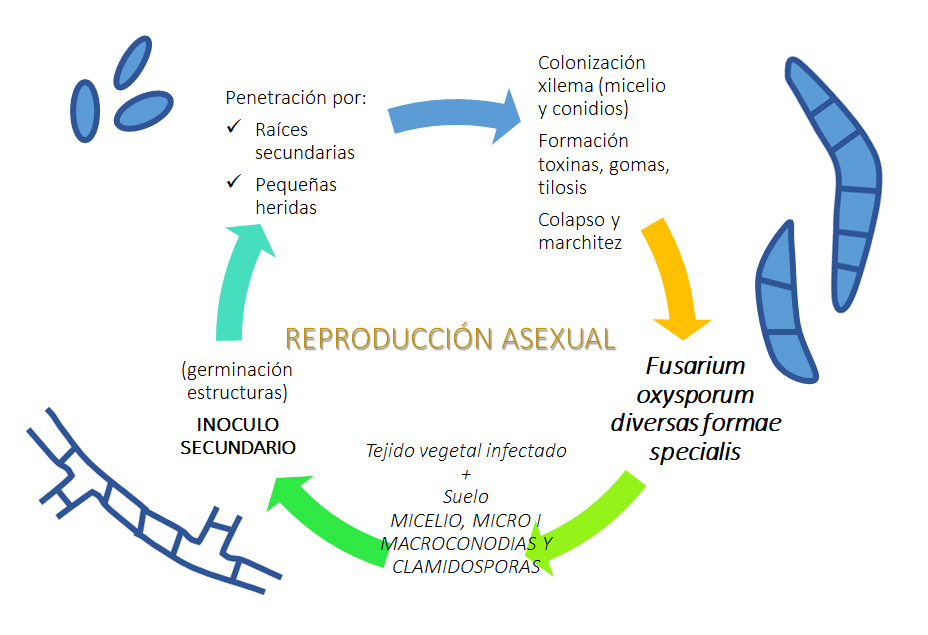
4. Ciclo de la enfermedad.
El patógeno se encuentra como saprófito en el suelo y se alimenta de la Materia Orgánica (M.O.). El inóculo primario está presente en el suelo.
- 1. Sobreviven en forma de micelio, micro/macroconidios y principalmente como clamidosporas (estrucutras de resistencia).
- 2. Germinarán y penetrarán por las raíces de las plantas.
- 3. Avanzan por el córtex de las raíces hacia los vasos xilemáticos.
- 4. En los vasos, el micelio produce microconidios que ascienden con la transpiración y transporte de agua y nutrientes.
- 5. Los vasos se colapsan además con las respuestas de defensa de las plantas (tilosis).
- 6. Clorosis-Marchitez (lateralidad) y finalmente la planta muere.

Daño visible en fruto causado por Fusarium oysporum f.sp. melonis
Las plantas responden a la infección produciendo fitoalexinas y al ascenso y dispersión de micelio y micrononidos del patógeno por el xilema con la formación de tilosis y gomas.
GLOSARIO
Modelo 3d del patógeno Fusarium spp.
– Fitoalexinas: conjunto de compuestos que pertenecen al grupo de metabolitos secundarios que tienen propiedades antimicrobianas ante hongos y bacterias patógenas. Es uno de los mecanismos de protección constitutivos (defensa pasiva) que presentan algunas plantas. (Fuente)
– Tilosis: Es un término de botánica. Es la acumulación anormal y generalizada de tílides especialmente el árboles por bloqueo en los vasos del duramen (cicatrices en la parte leñosa o xilema, madera) (fuente)
– Xilema: hace referencia al conjunto de vasos, parénquima y fibras que forman el tejido leñoso de las plantas metafitas, es decir, es el conjunto de vasos por los que circula la savia bruta. Se extiende por toda la planta, principalmente en tallo y hojas. (fuente: Qué es el XILEMA y su función – Resumen y esquemas
5. Manejo de la enfermedad (Control Integrado/Biológico)
1. Uso de variedades resistentes (cuando se disponga) y semillas de buena calidad.
2. Eliminar el material vegetal (reducir la supervivencia de esporas y cantidad de inóculo).
3. Reducir la humedad del suelo, mejorando el drenaje.
4. Solarización y/o biofumigación.
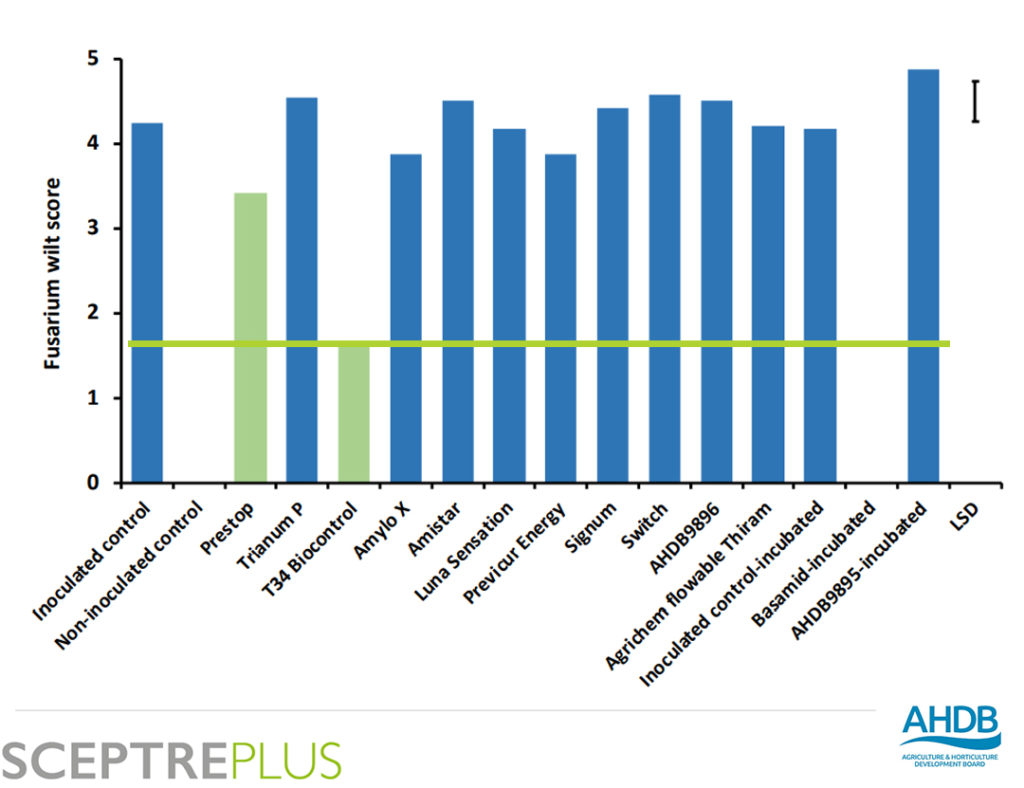
5. Control biológico con PPP o Productos para la Proteccion de los Cultivos: Productos Autorizados, como T34 Biocontrol, seguros, efectivos y testados*
SOLO PARA CONTROL INTEGRADO / SOLUCIÓN NO APTA PARA CONTROL BIOLÓGICO*
6. Control químico (es la última opción en el Control Integrado de las Enfermedades), hay productos eficaces, utilizar combinaciones para evitar la aparición de resistencias.
*El uso de productos químicos para el control de plagas en cultivos se ha visto reducido en los últimos años, por los daños a la salud y al medio ambiente asociados a su uso.
Por el contrario, T34 Biocontrol® no solo cuenta con la ventaja de ser un Agente de Control Biológico, sino que también es una solución efectiva que permite acelerar el desarrollo y crecimiento de la planta, incrementando la producción de los cultivos.
Estudios como el programa SceptrePlus, realizado por Agriculture and Horticulture Development Board UK (AHDB) ponen en evidencia los resultados de nuestro producto en comparación con otros del mercado (con mejores resultados que químicos y biológicos).
6. Tratamientos para el control de Fusarium oxysporum con T34 Biocontrol®.
T34Biocontrol es un producto fitosanitario registrado para el control de esta enfermedad. Es una solución efectiva y natural.
Recomendamos diferentes aplicaciones:
1. En semillero (medidas preventivas de control)
a. Mezclar T34 Biocontrol en el substrato, a la dosis de 10 g/m3. o
b. Pulverizar sobre las bandejas de semillero a razón de 0,5 g/m2.
2. Antes de transplante.
a. Baño de raíces con 0,01 g/L.
3. Durante el crecimiento
a. Aplicar T34 Biocontrol al sistema de riego, a la dosis de 0.o1 g/L en el suelo/ sustrato como medida preventida.
b. Una dosis recordatoria (0.01 g/L (500 g /Ha)), después de 8-12 semanas y previo a periodos de máximo estrés.
Fuentes:
Use of sewage sludge compost and Trichoderma asperellum isolates to supress Fusarium wilt of tomato. Cotxarrera, L., Trillas-Gay M.I., Steinberg, C., Alabouvette, C. 2002. Soil Biology & Biochemistry, 34: 467-476.
Substrates containing a Trichoderma asperellum strain for biological control of Fusarium and Rhizoctonia. Trillas and Cotxarrera, 2003. PATENTS: ES 2 188 385 B1, EP 1 400 586 B1, US 57,554,657 B2.
Composts from agricultural waste and the Trichoderma asperellum strain T-34 suppress Rhizoctonia solani in cucumber seedlings. Trillas, I., Casanova, E., Cotxarrera, L., Ordovás, J., Borrero, C., Avilés, M., 2006. Biological Control, 39:32-38.
Use of composts from agricultural and urbanwastes and Trichoderma asperellum (T34) to suppress Fusarium wilt of tomato. Trillas, M.I., Borrero, C., Castillo, S., Casanova, E., Segarra, G., Avilés, M., 2008. Journal of Plant Pathology, 90 (S3): 42.
Effectiveness of the biological control of Phytophthora capsici in pepper by Trichoderma asperellum strain T34. Segarra, G., Avilés, M., Casanova, E., Borrero, C., Trillas, I. 2013. Phytopathologia Mediterranea, 52:77-83.
Compost from forest cleaning green waste and Trichoderma asperellum strain T34 reduced incidence of Fusarium circinatum in Pinus radiata seedlings. López-López, N., Segarra, G., Vergara, O., López-Fabal, A., Trillas, M.I. 2016. Biological Control, 95:31-39.
Simultaneous quantitative LC–ESI-MS/MS analyses of salicylic acid and jasmonic acid in crude extracts of Cucumis sativus under biotic stress Segarra, G., Jáuregui, O., Casanova, E., Trillas, M.I. 2006, Phytochemistry 67:395-401.
Proteome, salicylic acid, and jasmonic acid changes in cucumber plants inoculated with Trichoderma asperellum strain T34. G. Segarra, E. Casanova, D. Bellido, M.A. Odena, E. Oliveira and I. Trillas. 2007. Proteomics 7, 3943–3952.
MYB72, a node of convergence in induced systemic resistance triggered by a fungal and a bacterial beneficial microbe. Segarra, G., Van der Ent, S., Trillas, I., Pieterse, C.M.J. 2009. Plant Biology 11:90-96.
Physiological effects of the induction of resistance by compost or Trichoderma asperellum strain T34 against Botrytis cinerea in tomato. Fernández, H., Segarra, G., Trillas, M. 2014. Biological control, 78: 77-85.
The secretion pattern of root exudates in tomato plants inoculated with Botrytis cinerea results in higher populations of Trichoderma asperellum strain T34 in the rhizosphere. Fernández, H., Trillas, M., Segarra, G. 2017. Plant Pathology, DOI 10.1111/ppa.12668.
Trichoderma asperellum strain T34 controls Fusarium wilt disease in tomato plants in soilless culture through competition for iron. Segarra, G., Casanova, E., Avilés, M., Trillas, I. 2010. Microbial Ecology 59:141-149.
Effect of ammonium/nitrate ratio in nutrient solution on control of Fusarium wilt of tomato by Trichoderma asperellum T34. Borrero, C., Trillas, M.I., Delgado, A., Avilés, M. 2011. Plant Pathology 61 (1).
Effect of Trichoderma asperellum strain T34 on iron nutrition in white lupin. de Santiago, A., Quintero, J.M., Avilés, M., Delgado, A. 2009. Soil Biology and Biochemistry, 41:2453-2459.
Effect of Trichoderma asperellum strain T34 on iron, copper, manganese and zinc uptake by wheat grown on a calcareous medium. de Santiago, A., Quintero, J.M., Avilés, M., Delgado, A. 2011. Plant and Soil 342:97-104
Effect of Trichoderma asperellum strain T34 and glucose addition on iron nutrition in cucumber grown on calcareous soil. de Santiago, A., García-López, A.M., Quintero, J.M., Avilés, M., Delgado, A. 2013. Soil Biology and Biochemistry, 57: 598-605.
Plant uptake of phosphorous from sparingly available P-sources as affected by Trichoderma asperellum T34. García-López, A.M., Avilés, M., Delgado, A. 2015. Agricultural and Food Science 24:249-260.